3.1 京牧康贝稳定化耐高温乳酸菌最新技术

京牧康贝稳定化耐高温包被乳酸菌示意图
 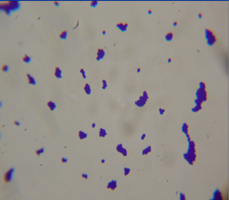 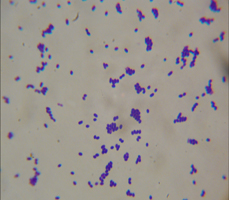
耐高温包被乳酸菌成品图 猪源粪肠球菌 鸡源粪肠球菌
核心包被材料(食品级)特点介绍:
最内层(第一层):前包被发酵(囊体成膜材料+固化剂)
第二层 :微囊成形(两种复方包被材质+保护剂)
第三层 :热敏制粒包衣(两种天然高分子复合材料)
第四层 :肠溶包衣(天然高分子复合材料)
注:第四层天然高分子肠溶材料为惰性材质,与维生素、矿物质、抗生素等活性添加剂不发生拮抗作用。
产品特点:
同源筛分、数年层层筛选优良菌株
本品所用菌种源自健康幼龄动物肠道,采用国际领先的16sRNA分子鉴定技术和BIOLOG鉴定技术、经过菌种繁殖力、肠道定植能力、养殖试验的层层筛选,高肠溶性包膜材质使乳酸菌微囊到达肠道才能被快速地溶解,在胃内不溶解。
领先、成熟的微囊工艺
采用国际领先的乳酸菌微囊化前包被技术、四层微囊化包被处理、稳定化处理技术及真空包装技术,公司通过ISO9001质量体系认证,以保证产品的有效活菌数和质量稳定性。
耐受性强
本品所用菌种经过反复的耐受性试验筛选而出,同时,四层微囊包被技术使产品能够耐受高温制粒、胃液和胆盐的破坏而没有损失,与饲料中抗生素、维生素和其他活性添加剂不发生拮抗作用。
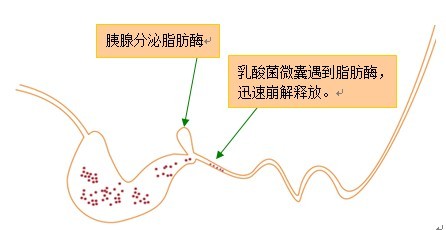
微囊分解示意图
3.2 高温高湿对包被粪肠球菌的影响及意义
经过选育的粪肠球菌在不进行稳定化处理前可以耐受60℃的高温环境,但不能抵抗饲料加工、制粒的高温,由于乳酸菌的抗逆性差,活菌在通过较长时间保存、饲料加工制粒的高温环境时容易导致乳酸菌活性降低。对乳酸菌用耐高温高湿的材料进行微囊包被后,可以抵抗饲料加工过程中高温、高湿等不良环境的影响。
3.2.1高温耐受性试验
⑴ 试验方法
以无菌操作称取固体乳酸菌样品1.0g,放入含有10粒无菌玻璃珠的无菌18×180试管中,将其放入已设定好温度的烘箱中(不塞棉塞),待温度显示为要求温度时开始计时,恒温,结束后迅速取出,塞棉塞,继续做稀释倾注计数实验。

⑵ 试验结果
高温对微囊化乳酸菌存活率的影响如表1所示。本试验人工模拟高温制粒的高温环境,以考察微囊化乳酸菌对高温环境的耐受性。研究表明经过90℃高温、2分钟,乳酸菌的存活率在90%以上。
表1 高温对微囊化乳酸菌存活率的影响
|
处理 |
处理时间 |
处理前活菌含量Cfu/g |
处理后活菌含量Cfu/g |
存活率 |
|
80℃高温 |
2 min |
1.03×1010 |
1.00×1010 |
97% |
|
85℃高温 |
2 min |
1.03×1010 |
0.95×1010 |
92% |
|
90℃高温 |
2 min |
1.03×1010 |
0.93×1010 |
90% |
3.2.2高温高湿耐受性试验
⑴ 试验方法
以无菌操作称取固体乳酸菌样品4.0g,放入干净干燥培养皿中,将其漂浮于已设定好温度的水浴锅水面上,不盖皿盖,盖上水浴锅的盖,水浴锅中插入一支温度计作为温度监测用,待温度显示为要求温度时开始计时,恒温,结束后迅速取出,继续做稀释倾注计数实验。
⑵ 试验结果
高温、高湿对微囊化乳酸菌存活率的影响如表2所示。本试验人工模拟高温制粒的高温高湿环境,以考察微囊化乳酸菌对高温高湿环境的耐受性。研究表明经过90℃高温高湿、60秒,乳酸菌的存活率仍为85%以上。
表2 高温、高湿对微囊化乳酸菌存活率的影响
|
80℃高温高湿 |
60 s |
1.03×1010 |
0.98×1010 |
95% |
|
85℃高温高湿 |
60 s |
1.03×1010 |
0.95×1010 |
92% |
|
90℃高温高湿 |
60 s |
1.03×1010 |
0.88×1010 |
85% |
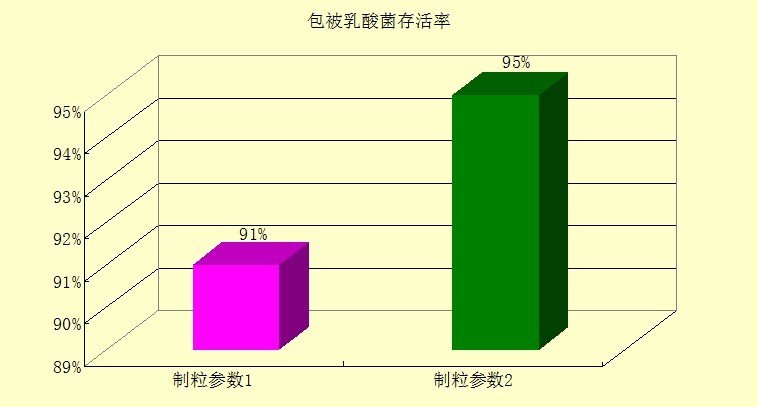
3.3 饲料加工对包被粪肠球菌的影响及意义 饲料加工时的调制温度一般在65~95℃,而且调制时间一般30-120秒,因此乳酸菌在进行调制时其活菌数下降非常迅速,不可能达到作为添加剂应具有的最低活菌含量(106CFU/g),所以也就不能够发挥良好的作用效果。乳酸菌在60℃以上时几乎不能存活,表明该乳酸菌在未经任何处理时,不能直接添加到饲料中进行制粒。 3.3.1 饲料加工试验 ⑴ 试验制备 制粒参数1:每吨模拟配合料(模拟配合料由玉米、小麦和沸石粉等组成)中添加微囊化乳酸菌100克,上海申德SDPM350制粒机,蒸汽125℃,制粒温度85℃,调质30秒,调质下料口70℃,环模压缩比10:1,粒径2.5。 制粒参数2:每吨模拟配合料(模拟配合料由玉米、小麦和沸石粉等组成)中添加微囊化乳酸菌50克,制粒温度78℃,调质30秒,调质下料口65℃,环模压缩比9:1,粒径4.0。 采样时必须特别注意样品的代表性和避免采样时的污染。用灭菌牛皮纸袋或广口瓶,金属勺和刀,在卫生学调查基础上,采取有代表性的样品,粉碎过0.45mm孔径筛,用四分法缩减至250g。 ⑵ 试验方法 ① 以无菌操作称取检样1.00g(或1.00mL),放入含有99mL无菌水的玻璃三角瓶(含玻璃珠、已干灭)中,上30℃,200r/min振荡60min,即为1:100的稀释液。 ② 取0.5mL1:100的稀释液注入含有4.5mL无菌水离心管中,涡旋混匀,此为1:1000的稀释液。 ③ 按上述操作顺序做10倍递增稀释液,每稀释一次,换用一个1mL无菌吸头,根据对样品污染情况的估计,选择三个合适的稀释度,分别在做10倍稀释的同时,吸取1mL稀释液于无菌平皿中,每个稀释度做三个平皿,然后将凉至45℃左右的培养基注入平皿中,充分混匀,待琼脂凝固后,倒置于37℃±1℃恒温培养箱中,培养2-3d后取出,计算平板内乳酸菌总数目,乘以稀释倍数,即得每克试样所含乳酸菌总数。 ⑶试验结果 乳酸菌耐受饲料加工试验结果如图1所示:
3.4 耐酸实验及意义
由于仔猪出生时胃内PH值在5~6之间,然后因高产酸细菌定植而逐渐下降,数小时后pH值即降至4左右,2月龄前保持在pH 3左右,成年猪的最低pH值可达到1.5。乳酸菌要进入仔猪消化道起作用,首先应该能够耐受较低pH值的酸性环境,这种酸度对许多乳酸菌来说都是不耐受的。故一般设置最低pH2.0作为考察微囊化乳酸菌耐受胃酸的指标。
3.4.1 胃酸耐受性试验
⑴ 胃液的配置
① PBS缓冲液
|
氯化钠 |
8g |
|
氯化钾 |
0.2g |
|
磷酸氢二钠(Na2HPO4·12H2O) |
3.63g |
|
磷酸二氢钾 |
0.24g |
|
纯净水 |
1000mL |
② 调整pH值
用6mol/L的HCl调以上PBS缓冲液pH至2.0、3.0和4.0,分装30ml至150mL含有玻璃珠的无菌三角瓶中,包扎,121℃灭菌20min,在无菌室以1g/100ml比例加胃蛋白酶。
⑵ 耐胃酸检测方法
准确称取0.30g待测固体样品置于以上不同pH值的溶液中,37℃培养 2 h,进行稀释平板菌落培养计数。
⑶ 试验结果 胃酸对微囊化乳酸菌存活率的影响如表3所示。食物在畜禽动物胃里的停留时间一般为1-2小时,本试验人工模拟胃液环境,当胃液的ph值为4,经过120分钟,乳酸菌的存活率为95%;当胃液的ph值为3,经过120分钟,乳酸菌的存活率为93%;当胃液的ph值为2、经过120分钟,乳酸菌的存活率仍为92%。
表3 胃酸对微囊化乳酸菌存活率的影响
|
PH值
处理时间 |
PH 2.0 |
PH 3.0 |
PH 4.0 |
|
活菌数cfu/mL |
存活率 |
活菌数cfu/mL |
存活率 |
活菌数cfu/mL |
存活率 |
|
0 min |
1.01×1010 |
|
1.04×1010 |
|
1.02×1010 |
|
|
60 min |
0.98×1010 |
97% |
1.02×1010 |
98% |
1.01×1010 |
99% |
|
90 min |
0.96×1010 |
95% |
0.99×1010 |
95% |
1.00×1010 |
98% |
|
120 min |
0.93×1010 |
92% |
0.97×1010 |
93% |
0.97×1010 |
95% |
3.5 耐胆盐实验及意义
研究表明,由肝脏分泌到十二指肠的高浓度的胆盐具有抗菌活性,它对细胞膜有很强的破坏力,它的疏水作用可导致膜蛋白离解和细胞膜破裂。故益生菌要顺利进入动物肠道,除具有可耐受胃中低pH值的能力外,还需具备耐受小肠中胆汁等形成的高渗透压环境的能力。小肠中胆汁盐含量在0.03%-0.3%之间波动,故采用0.3%胆盐作为筛选耐受肠道内胆盐的指标。

3.5.1 胆盐耐受性试验
⑴ 胆盐溶液的制备
① PBS缓冲液
|
氯化钠 |
8g |
|
氯化钾 |
0.2g |
|
磷酸氢二钠(Na2HPO4·12H2O) |
3.63g |
|
磷酸二氢钾 |
0.24g |
|
纯净水 |
1000mL |
用6mol/L的HCl调pH至7.4,分装30mL至150mL无菌三角瓶中,包扎,121℃灭菌20min,备用。
② 3%胆盐溶液
准确称取3.0g胆盐,用100mL纯净水溶解,分装至250mL无菌三角瓶中,121℃灭菌20min。
③ 含胆盐的0.10%、0.20%、0.30%PBS液
在30mL的pH7.4的PBS溶液中加入1.0mL、2.0ml、3.0ml的3%胆盐溶液,涡旋混匀,此为含胆盐0.10%、0.20%、0.30%的PBS溶液。
⑵ 耐胆盐检测方法
准确称取0.30g待测固体样品置于以上不同胆盐浓度的溶液中,37℃培养 2 h,进行稀释平板菌落培养计数。
⑶ 试验结果
胆盐对微囊化乳酸菌存活率的影响如表4所示。由表4可见,随着胆盐浓度的升高,时间的延长,乳酸菌的存活率不断降低,当胆盐浓度0.2%、经过2小时后乳酸菌的存活率为94%,当胆盐浓度0.3%,经过2小时后乳酸菌的存活率仍为93%。
表4 胆盐对微囊化乳酸菌存活率的影响
|
pH值
时间 |
0.1% |
0.2% |
0.3% |
|
活菌数cfu/mL |
存活率 |
活菌数cfu/mL |
存活率 |
活菌数cfu/mL |
存活率 |
|
0h |
1.02×1010 |
|
1.03×1010 |
|
1.02×1010 |
|
|
1h |
1.01×1010 |
99% |
1.00×1010 |
97% |
0.98×1010 |
96% |
|
2h |
0.99×1010 |
97% |
0.97×1010 |
94% |
0.95×1010 |
93% |
3.6 胃液的敏感试验及意义
动物的pH值范围在2.0-7.0之间,通常胃液pH为3.0左右,pH值在2.0-3.0时,具有较强的杀菌作用。食物在胃内的停留时间在1-2小时,菌株必须具备较强的耐酸力和耐受胃蛋白酶的能力,才能保证到达肠道的活菌数。
3.6.1 对胃液的敏感试验
(1)人工胃液配置方法
取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释至1000ml,即得。
(2)试验方法
菌种活化后取10%接种量转接100ml液体MRS培养基,37℃、100r/min培养至8.5h,10%接种量接于人工胃液中,用HCl和0.1N的Na0H调pH为2.0、3.0、4.0,置37℃培养,分别于第0 min、60min、90min、120min,取lml菌悬液,作活菌计数,计算在各pH条件下,细菌存活率,并设0min空白对照。
3.6.2 试验结果
胃液对微囊化乳酸菌存活率的影响如表1所示。本试验人工模拟胃液环境,当胃液的ph值为4,经过120分钟,乳酸菌的存活率为96%;当胃液的ph值为3,经过120分钟,乳酸菌的存活率为94%;当胃液的ph值为2、经过120分钟,乳酸菌的存活率仍为93%。
表1 胃液对微囊化乳酸菌存活率的影响
|
时间 |
pH=2.0 |
pH=3.0 |
pH=4.0 |
|
0 min |
1.06×1010 |
|
1.06×1010 |
|
1.06×1010 |
|
|
60min |
1.02×1010 |
96% |
1.03×1010 |
97% |
1.06×1010 |
100% |
|
90min |
1.00×1010 |
94% |
1.01×1010 |
95% |
1.03×1010 |
97% |
|
120min |
0.99×1010 |
93% |
1.00×1010 |
94% |
1.02×1010 |
96% |
3.7 肠液的敏感试验及意义
食糜由胃进入小肠后,即开始小肠内的消化,小肠内消化是整个消化过程中重要的阶段,也各种益生菌制剂发挥作用的主要场所。小肠液的pH值弱碱性,约为7.6左右,益生菌只有经受住小肠液的作用,保持一定数量的存活菌数才能发挥作用。
3.7.1 对肠液的敏感试验
(1)人工肠液
取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节PH值至6.8,取胰酶10g,加水量使溶解,将两液混合后,加水稀释至1000ml即得。
(2)试验方法
菌种活化后按10%的接种量接入到上述人工肠液,同时设不加人工肠液的MRS培养基为空白对照组。37℃培养,140r/min,分别于第0min、60min、120min和240min取样,稀释适当倍数进行活菌计数。
3.7.2 试验结果
肠液对微囊化乳酸菌存活率的影响如表2所示。本试验人工模拟肠液环境,当胃液的ph值为6.8,经过240分钟,乳酸菌的存活率为101%。
表2 肠液对微囊化乳酸菌存活率的影响

3.8 抑菌试验及意义
乳酸菌是动物机体肠道正常菌群中的优势菌,能够产生有机酸(如乳酸、乙酸、丙酸等)、双乙酰、过氧化氢等化合物,能够抑制腐败菌和病原菌。大肠杆菌在正常条件下是机体肠道的正常菌群,但在异位时或当机体抵抗力下降时又可能成为条件致病菌,引起各种感染。乳酸菌除了能够代谢产生各种抑菌物质,乳酸菌还与小肠黏膜上皮细胞结合,起占位作用,对有害菌有屏障排除能力。
3.8.1 抑菌试验
(l) 发酵上清液制备:
菌种活化后取10%接种量转接100 ml液体MRS培养基,37℃、100r/min培养至15h,5000r/min离心取上清液,以0.22μm微孔滤膜过滤除菌后,得发酵上清液。
(2) 指示菌的准备:
将大肠杆菌K88接种至LB培养基中,37℃培养至对数生长期,调整菌液浓度为 2×108cfu/ml。
(3) 方法:打孔法
将活化好的指示菌悬液分别取1ml加入到培养皿中,倒入冷却至50℃左右的营养琼脂培养基,凝固后在超净工作台上每个平板打3个小孔,琼脂封底后,每孔分别注入粪肠球菌发酵上清液100μL,置于37℃培养20h取出平板,用游标卡尺测量抑菌圈直径。
3.8.2 试验结果
|
测定项目 |
大肠杆菌K88 |
|
抑菌圈直径(mm) |
17.28 |
图1 乳酸菌对大肠杆菌的抑菌圈

3.9 药敏试验及意义
抗生素在治疗动物疾病上效果显著,但亦带来菌群失调症的不良影响。如果筛选对生产中常用饲用抗生素有耐受性的乳酸菌菌株,与该种抗生素联合使用,可增强预防和治疗畜禽疾病的效果,同时预防和及时调整因抗生素引起的菌群失调。
3.9.1 药敏试验
(1)抗生素配置
将饲料常用抗生素按实际使用量配置成适当浓度(饲料常用抗生素有:黄霉素、莫能菌素、金霉素、杆菌肽锌、维吉尼亚霉素、氨苯砷酸、喹乙醇、硫酸粘杆菌素、吉它霉素、盐霉素钠)。
(2) 指示菌的准备:
粪肠球菌活化后取10%接种量转接100ml液体MRS培养基,37℃、180r/min培养至8.5 h。
(3) 试验方法:药敏片法
将活化好的指示菌悬液分别取1ml加入到培养皿中,倒入冷却至50℃左右的MRS培养基,凝固后贴上药品片,置于37℃培养20h取出平板,用游标卡尺测量抑菌圈直径。
3.9.2 试验结果
|
抗生素 |
国家规定添加量
(配合饲料,ppm) |
乳酸菌
耐受抗生素浓度
(配合饲料,ppm) |
|
黄霉素 |
5~25 |
125 |
|
莫能菌素 |
90~110 |
550 |
|
金霉素 |
20~75 |
600 |
|
杆菌肽锌 |
4~100 |
800 |
|
维吉尼亚霉素 |
10~25 |
175 |
|
氨苯砷酸 |
50~100 |
800 |
|
喹乙醇 |
50~100 |
400 |
|
硫酸粘杆菌素 |
2~40 |
320 |
|
吉它霉素 |
5~330 |
1800 |
|
盐霉素钠 |
10~75 |
450 |
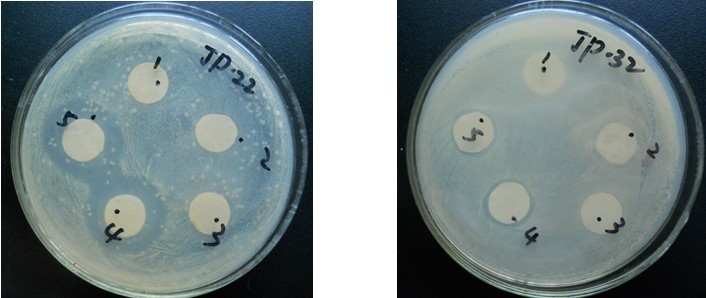
图1乳酸菌耐受黄霉素试验 图2乳酸菌耐受金霉素试验
3.10 耐保存试验及其意义
益生菌属微生物类,外界因素如温度、湿度、酸度、环境的氧含量、保存时间等都不同程度地影响其活力。乳酸菌不形成芽孢,对温度、氧气、光线、水分等外界因素非常敏感,容易受到外界因素的影响而引起产品活菌数的下降。将乳酸菌进行微囊化的优点在于:(1)可将菌体与外界的不良环境分开,方便保存;(2)形成固体微颗粒,利于在预混料中的均匀分布,也有利于储存和运输;(3)采用肠溶性壁材后,能防止胃液的破坏。
⑴ 试验用品
自封袋、密封较好的样品箱、干湿温度计以及检测有效活菌数所需用品。
⑵ 保存方法
根据生产计划,对每批成品进行取样,取样量为200g,用四分法进行缩分,取其中10g用于活菌数量检测。每隔30天对样品进行一次活菌数量检测。温度为常温保存(一般温度在0-40℃),相对湿度20-70%,无有毒有害物质,无刺激性较强物质,无特殊气味物质。
⑶ 活菌检测方法
① 以无菌操作称取检样1.00g(或1.00mL),放入含有99mL无菌水的玻璃三角瓶(含玻璃珠、已干灭)中,上30℃,200r/min振荡60min,即为1:100的稀释液。
② 取0.5mL1:100的稀释液注入含有4.5mL无菌水离心管中,涡旋混匀,此为1:1000的稀释液。
③ 按上述操作顺序做10倍递增稀释液,每稀释一次,换用一个1mL无菌吸头,根据对样品污染情况的估计,选择三个合适的稀释度,分别在做10倍稀释的同时,吸取1mL稀释液于无菌平皿中,每个稀释度做三个平皿,然后将凉至45℃左右的培养基注入平皿中,充分混匀,待琼脂凝固后,倒置于37℃±1℃恒温培养箱中,培养2-3d后取出,计算平板内乳酸菌总数目,乘以稀释倍数,即得每克试样所含乳酸菌总数。
⑷ 试验结果
乳酸菌耐保存试验结果如图1所示:
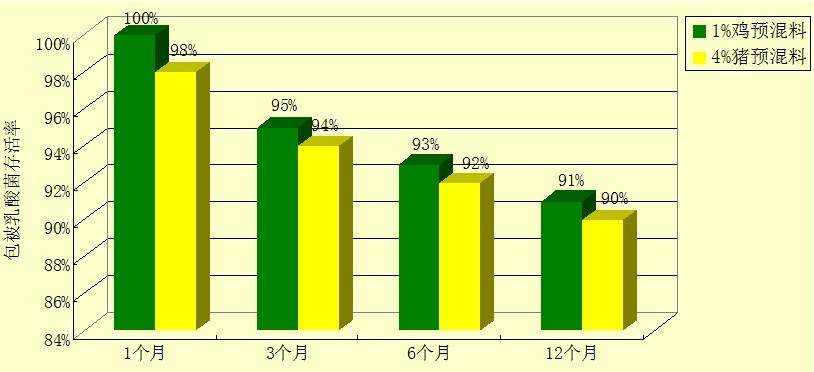
图1
3.11 答读者问
3.11.1 动物肠道主要靠消化酶消化食物,微生物能起到多大的作用呢?
答:动物前肠和中肠主要靠消化酶消化食物,后肠主要靠微生物消化食物,因此如果大肠部位的微生物发生紊乱时,就会导致动物腹泻等肠道疾病。
3.11.2 目前动物微生态制剂中使用天然菌株较多还是诱变菌株较多?
答:目前用于动物微生态制剂的菌株多为天然菌株,诱变菌株由于其安全性的考虑目前主要用于技术储备。
3.11.3 饲料中的水溶性淀粉多糖含量过高时会影响氨基酸的利用率,在饲料中添加氨基酸能够提高氨基酸的利用率吗?
答:氨基酸利用率与饲料中直链淀粉含量有关。微生态制剂可以提高动物肠道微生物多样性,提高动物肠道内源性氨基酸分泌量,可以降低肉品中吲哚和粪臭素含量,改善肉质品质。
3.11.4 贵公司进行菌种筛选时,主要针对其那些特性进行筛选?
答:分别对菌种抑菌特性、耐高温、耐酸、耐胆盐、耐储存和肠道定值能力等关键指标进行筛选。肠道定值能力和抑菌特性是菌种能够发挥益生作用的重要决定性因素,耐性筛选保障菌株能够耐受外界、胃肠道不良环境的影响到达肠道发挥作用。
3.11.5 包被发酵的原理是什么?
答:包被发酵的原理是在菌体发酵生长到一定阶段以后,向发酵液中注入特殊的包被材料,这个包被材料能将菌体吸附囊包后生长,菌体在囊才形成的一个小空间中生长,囊材具有选择透过性,小分子的营养物质可以进入囊材形成的空间,供菌体生长,同时囊材为菌种提供了一个厌氧环境,能促进菌体生长,达到较高的活菌数,同时这个厌氧环境还可以防止杂菌污染,菌体包被后还可以提高菌体的稳定性,保证后处理过程中活菌数的稳定。
3.11.6 产品在动物体内的作用机理?
答:我公司复合菌产品主要包括耐高温包被乳酸菌(猪源性粪肠球菌)、枯草芽孢杆菌、酵母菌,三种菌共同的作用机理是促进肠道内微生物的增殖,进而调整和维持肠道内微生物平衡。但是三者优势互补、协同增效。
好实沃乳酸菌属猪源性乳酸菌,促进肠道内微生物增殖效果最快最优,抑制病原菌效果最优(4-6小时具有明显抑菌效果),同时具有增强免疫力效果,机理为在肠道的粘附力、繁殖力强,世代时间20分钟,进入肠道后能够在胃肠道粘膜表面形成一层有益的微生物膜,从而有效抑制有害菌在胃肠道的定植,快速恢复肠道菌群平衡,同时,乳酸菌能够产生乳酸、过氧化氢、乳酸菌素等抑菌物质抑制有害菌的生长繁殖;
好实沃枯草芽孢杆菌是外源性细菌(或叫过路菌),利用耗氧速度快(世代时间19分钟),产生厌氧环境促进肠道内微生物增殖(肠道内有益菌为厌氧菌),抑制病原菌(20-30小时具有明显抑菌效果),产蛋白酶力强(尤其是产生分解氨气、硫化氢的酶)消除体内有毒害异味效果显著;
酵母菌能为肠道内微生物提供丰富的营养物质,其富含脂肪酸、核苷酸、酵母葡聚糖、寡糖、多肽、氨基酸等,能够补充饲料养分,并产生多种消化酶类,提高饲料消化利用率。
好实沃菌种复合原理和特点如下:
①内外复合:内源菌(粪肠球菌)和外源菌(枯草芽孢杆菌、酵母菌)复合;
②强强联合:肠道内耐逆性强菌(粪肠球菌)和肠道外耐逆性强菌(枯草芽孢杆菌、酵母菌)复合;
③单种菌和复合菌均能快速增殖体内微生物;
④协同增效:复合菌在一定的添加量范围无拮抗作用,协同增效;
⑤抑菌效果强:均对大肠杆菌有很强的抑制作用;
⑥安全性高:菌种来源清晰,同源性最佳,不含杂菌。
|

